Determination of Valences of As, Cr, Sb and Se in Soil Using HPLC-HG-AFS
-
摘要:
土壤重金属污染物的环境效应与其无机价态有密切的关系。As、Cr、Sb和Se元素的价态测定意义重大,但由于价态之间易发生转化使测定工作存在较大难度,标准化程度较低。地质行业标准DD2005-3推荐使用离子交换树脂分离,原子荧光光谱差减法测定As、Sb、Se价态及石墨炉原子吸收光谱法(GFAAS)测定Cr价态。这些方法前处理操作繁琐,测定次数多,工作量大,其他元素形态的存在还会导致结果出现误差。为满足地质调查和评价的需要,本文建立了一套适用于测定土壤水溶态和离子交换态提取液中As、Cr、Sb、Se价态的方法。样品在50℃水浴振荡加热浸提30min,采用液相色谱-原子荧光光谱法(LC-AFS)分离并测定As、Sb、Se价态,一次进样元素的两种无机价态按顺序出峰,同时测定,简便易行,结果更可靠。为了避免了某些离子交换提取剂的屏蔽和干扰,作为补充建立了AFS选择性测定Sb、Se价态的方法,设备成本较低。对于Cr价态的测定,建立了阳离子交换树脂分离-电感耦合等离子体质谱(ICP-MS)的方法,比推荐的GFAAS测定法灵敏度高。As、Cr、Sb和Se的检出限≤0.02μg/g,RSD为3.8%~10.7%,加标回收率为91.0%~106.0%。应用色谱方法对采集的土壤样品进行检测,各项指标满足规范DD2005-3质量要求,与非色谱法相比,实现多组分同时测定。同时初步研究表明,土壤中元素价态含量不高,与土壤总量不存在相关性,采用价态含量作为环境风险评估指标更为合适。
Abstract:BACKGROUND The environmental effects of heavy metal pollutants in soil are closely related to their inorganic valence. The determination of the valences of As, Cr, Sb and Se elements is of great significance, but due to the easy conversion between the valences, the determination is difficult and the degree of standardization is low. The geological industry standard DD2005-3 recommends the use of ion exchange resin separation, atomic fluorescence spectrometry to determine the valences of As, Sb, and Se, and graphite furnace atomic absorption spectrometry (GFAAS) to determine the valence of Cr. The preparation of these methods is cumbersome, the number of measurements is large, the workload is large, and the existence of other element forms can also cause errors in the results.
OBJECTIVES To establish a set of methods suitable for determining the valences of water-soluble and exchangeable As, Cr, Sb and Se in soil samples.
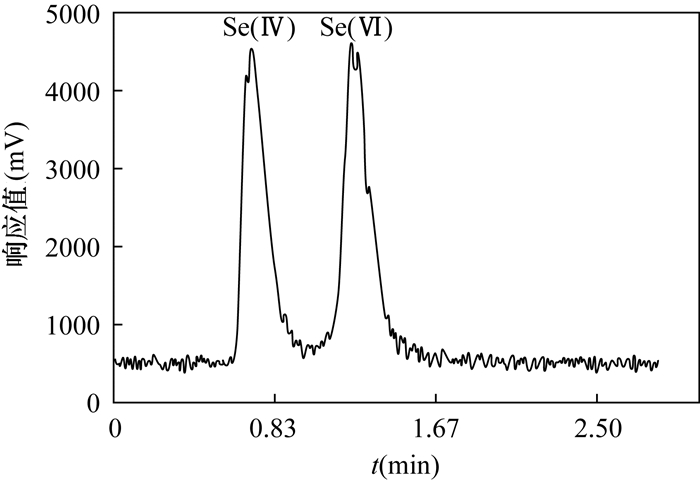
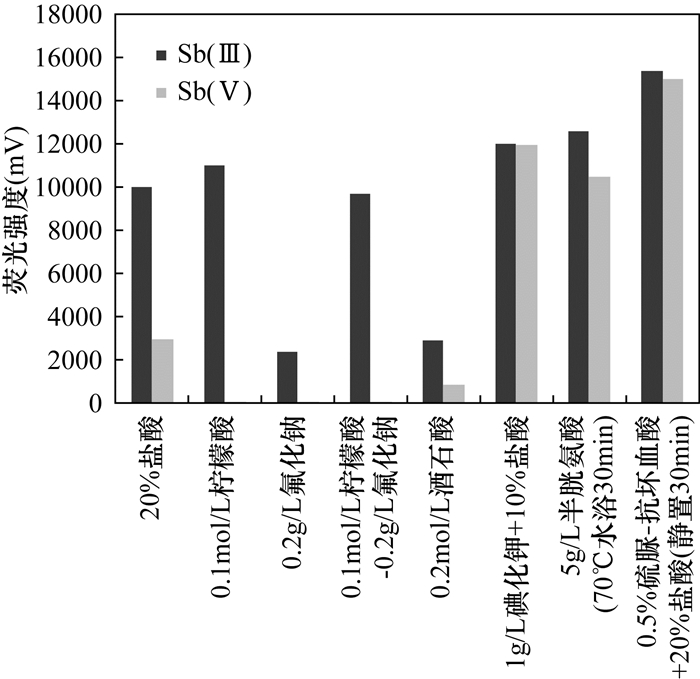
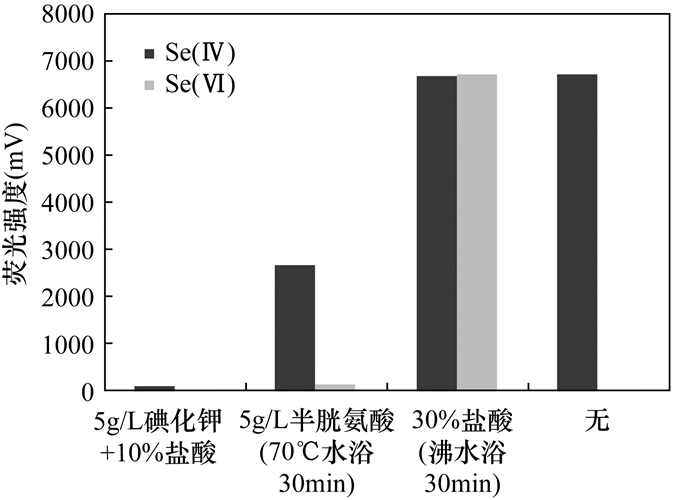
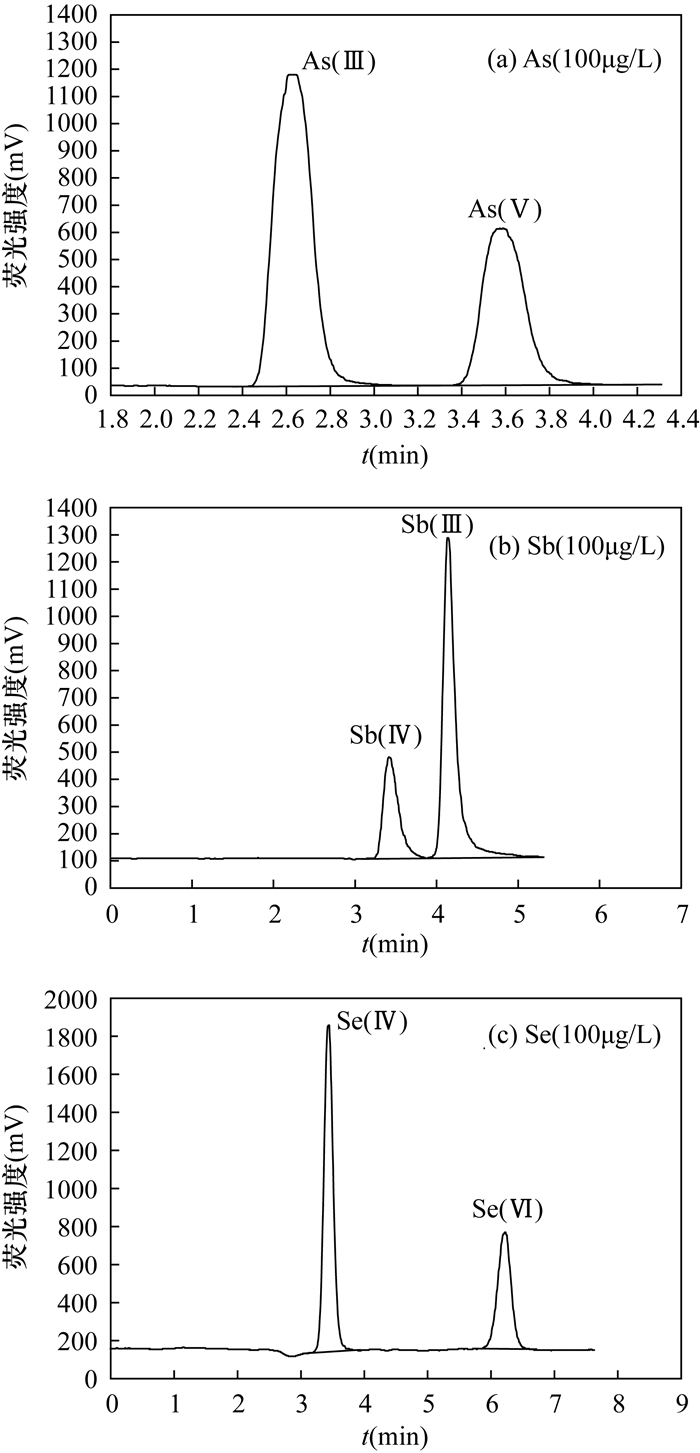
METHODS The valences of As, Sb and Se were separated and determined by HPLC-HG-AFS after 30 min extraction in a water bath of 50℃. The processes were simpler and more accurate than the recommended subtraction processes by AFS. To avoid the masking action of some extracting agent, the method of selective determination of Sb(Ⅲ), Sb(Ⅴ), Se(Ⅳ) and Se(Ⅵ) by AFS was developed, which has the advantage of low instrument cost. As for Cr(Ⅲ) and Cr(Ⅵ), after separation by ion-exchange resin, they were determined by ICP-MS, which has higher sensitivity than the recommended GFAAS.
RESULTS The detection limits of As(Ⅲ), As(Ⅴ), Cr(Ⅲ), Cr(Ⅵ), Sb(Ⅲ), Sb(Ⅴ), Se(Ⅳ) and Se(Ⅵ) was ≤ 0.02μg/g, with the RSD of 3.8%-10.7% and the recovery of 91.0%-106.0%. These methods were successfully applied to the analysis of geological samples, and all indices met the quality requirements of DD2005-3.
CONCLUSIONS Compared with non-chromatographic methods, newly established methods by HPLC-HG-AFS can determine multiple components simultaneously. At the same time, preliminary studies have shown that the valence content of elements in the soil is not high, and lacks correlation with the total amount of soil.
-
Key words:
- As /
- Cr /
- Sb /
- Se /
- valence detection /
- liquid chromatography-atomic fluorescence spectrometry
-
-
表 1 土壤中As、Cr、Sb和Se价态方法线性范围、检出限、精密度(RSD)和加标回收率
Table 1. Linear range, method detection limit, relative standard deviation and standard addition recovery of As, Cr, Sb and Se in soil samples
形态及分析方法 元素价态 线性范围(μg/L) 检出限(μg/g) RSD(%) 平均加标回收率(%) 水溶态(HPLC-HG-AFS) As(Ⅲ) 1~200 0.008 7.5 94.0~105.0 As(Ⅴ) 1~200 0.012 6.8 98.0~102.5 离子交换态(HPLC-HG-AFS) As(Ⅲ) 2~500 0.007 5.0 92.0~100.5 As(Ⅴ) 2~500 0.012 4.6 94.5~97.5 水溶态(ICP-MS) Cr(Ⅲ) 1~500 0.011 9.6 96.5~100.5 Cr(Ⅵ) 1~500 0.008 4.1 96.0~99.0 离子交换态(ICP-MS) Cr(Ⅲ) 1~500 0.008 10.7 96.0~10.0 Cr(Ⅵ) 1~500 0.012 7.9 95.0~98.0 水溶态(HPLC-HG-AFS) Sb(Ⅲ) 1~20 0.010 6.9 94.5~99.5 Sb(Ⅴ) 1~20 0.015 5.4 97.5~102.0 水溶态(HG-AFS差减法) Sb(Ⅲ) 1~20 0.007 3.6 97.5~100.5 Sb(Ⅴ) 1~20 0.008 4.5 92.5~101.0 离子交换态(HG-AFS差减法) Sb(Ⅲ) 1~20 0.010 5.5 93.5~99.0 Sb(Ⅴ) 1~20 0.011 6.1 97.0~99.5 水溶态HPLC-HG-AFS Se(Ⅳ) 1~50 0.010 3.9 96.0~101.0 Se(Ⅵ) 1~50 0.020 5.9 91.0~96.0 离子交换态(HPLC-HG-AFS) Se(Ⅳ) 1~50 0.012 5.4 99.0~103.0 Se(Ⅵ) 1~50 0.020 7.8 94.0~106.0 水溶态(HG-AFS差减法) Se(Ⅳ) 1~50 0.010 4.9 99.0~106.0 Se(Ⅵ) 1~50 0.014 4.8 97.0~99.0 离子交换态(HG-AFS差减法) Se(Ⅳ) 1~50 0.012 6.7 95.0~101.0 Se(Ⅵ) 1~50 0.018 5.3 92.0~96.0 表 2 实际土壤样品中As、Cr、Sb和Se价态含量
Table 2. Content of As, Cr, Sb and Se in actual soil samples
分析项目 测定方法 组分 As含量(μg/g) N01 N02 N03 N04 N05 全量 HG-AFS 总As 161.39 454.35 14.74 12.70 12.90 水溶态 HG-AFS As < 0.02 0.05 1.84 0.05 0.07 HPLC-HG-AFS As(Ⅲ) < 0.02 0.06 0.68 < 0.02 < 0.02 HPLC-HG-AFS As(Ⅴ) < 0.02 < 0.02 1.12 0.04 0.07 离子交换态 HG-AFS As 13.20 43.31 4.06 1.28 1.70 HPLC-HG-AFS As(Ⅲ) 0.12 0.23 0.72 < 0.02 0.03 HPLC-HG-AFS As(Ⅴ) 13.10 43.02 3.31 1.29 1.66 分析项目 测定方法 组分 Cr含量(μg/g) N06 N07 N08 N09 N10 全量 ICP-MS 总Cr 23.1 326.7 50.7 6.58 410.0 水溶态 ICP-MS Cr 0.05 0.78 0.07 0.08 0.40 Cr(Ⅲ) 0.05 0.04 < 0.02 < 0.02 0.02 Cr(Ⅵ) < 0.02 0.76 0.07 0.08 0.37 离子交换态 ICP-MS Cr 0.23 0.27 0.13 0.13 0.11 Cr(Ⅲ) < 0.02 0.03 < 0.02 < 0.02 < 0.02 Cr(Ⅵ) 0.23 0.22 0.12 0.14 0.11 分析项目 测定方法 组分 Sb含量(μg/g) N11 N12 N13 N14 N15 全量 AFS 总Sb 1.21 2.26 3.20 3.77 1.23 水溶态 HG-AFS Sb 0.03 0.03 0.07 0.03 0.08 HG-AFS Sb(Ⅲ) 0.03 0.03 0.02 0.03 0.03 HG-AFS差减法 Sb(Ⅴ) < 0.02 0.02 0.05 < 0.02 0.05 HPLC-HG-AFS Sb(Ⅲ) 0.03 0.04 0.02 0.03 0.03 HPLC-HG-AFS Sb(Ⅴ) < 0.02 0.02 0.05 < 0.02 0.06 离子交换态 HG-AFS Sb < 0.02 < 0.02 0.09 < 0.02 < 0.02 HG-AFS Sb(Ⅲ) < 0.02 < 0.02 0.04 < 0.02 < 0.02 HG-AFS差减法 Sb(Ⅴ) < 0.02 < 0.02 0.05 < 0.02 < 0.02 Se 测定方法 组分 Se含量(μg/g) N16 N17 N18 N19 N20 全量 AFS 总Se 1.26 2.38 8.52 0.74 1.63 水溶态 HG-AFS Se < 0.02 < 0.02 < 0.02 < 0.02 < 0.02 HG-AFS Se(Ⅳ) < 0.02 < 0.02 < 0.02 < 0.02 < 0.02 HG-AFS差减法 Se(Ⅵ) < 0.02 < 0.02 < 0.02 < 0.02 < 0.02 HPLC-HG-AFS Se(Ⅳ) < 0.02 < 0.02 < 0.02 < 0.02 < 0.02 HPLC-HG-AFS Se(Ⅵ) < 0.02 < 0.02 < 0.02 < 0.02 < 0.02 离子交换态 HG-AFS Se 0.14 0.08 0.15 0.05 0.01 HG-AFS Se(Ⅳ) 0.14 0.08 0.15 0.05 0.01 HG-AFS差减法 Se(Ⅵ) < 0.02 < 0.02 < 0.02 < 0.02 < 0.02 HPLC-HG-AFS Se(Ⅳ) 0.13 0.08 0.16 0.04 < 0.02 HPLC-HG-AFS Se(Ⅵ) < 0.02 < 0.02 < 0.02 < 0.02 < 0.02 -
[1] 章海波, 骆永明, 李远, 等. 中国土壤环境质量标准中重金属指标的筛选研究[J]. 土壤学报, 2014, 51(3): 429-438. https://www.cnki.com.cn/Article/CJFDTOTAL-TRXB201403001.htm
Zhang H B, Luo Y M, Li Y, et al. Screening of criteria for heavy metals for revision of the national standard for soil environmental quality of China[J]. Acta Pedologica Sinica, 2014, 51(3): 429-438. https://www.cnki.com.cn/Article/CJFDTOTAL-TRXB201403001.htm
[2] 于兆水, 张勤. 氢化物发生-原子荧光光谱法测定土壤中水溶态和可交换态锑(Ⅲ)和锑(Ⅴ)[J]. 岩矿测试, 2010, 29(1): 34-38. doi: 10.3969/j.issn.0254-5357.2010.01.008 http://www.ykcs.ac.cn/article/id/ykcs_20100108
Yu Z S, Zhang Q. Determination of water soluble and exchangeable Sb(Ⅲ) and Sb(Ⅴ) in soil samples by hydride generation-atomic fluorescence spectrometry[J]. Rock and Mineral Analysis, 2010, 29(1): 34-38. doi: 10.3969/j.issn.0254-5357.2010.01.008 http://www.ykcs.ac.cn/article/id/ykcs_20100108
[3] 周康民, 汤志云, 肖灵, 等. 土壤及水中As价态分析方法研究[J]. 地质学刊, 2008, 32(3): 189-197. doi: 10.3969/j.issn.1674-3636.2008.03.006
Zhou K M, Tang Z Y, Xiao L, et al. Study on analysis method of As valence state in soil and water mass[J]. Journal of Geology, 2008, 32(3): 189-197. doi: 10.3969/j.issn.1674-3636.2008.03.006
[4] 郝志红, 杨帆, 邢夏, 等. 氢化物发生-原子荧光光谱法测定地质样品中的锑(Ⅲ)和锑(Ⅴ)[J]. 物探与化探, 2012, 36(6): 947-951. https://www.cnki.com.cn/Article/CJFDTOTAL-WTYH201206012.htm
Hao Z H, Yang F, Xing X, et al. The determination of antimony(Ⅲ) and of antimony(Ⅴ) in geological samples by hydride generation-atomic fluorescence spectrometry[J]. Geophysical & Geochemical Exploration, 2012, 36(6): 947-951. https://www.cnki.com.cn/Article/CJFDTOTAL-WTYH201206012.htm
[5] 肖融, 张新智, 王昌钊, 等. 氢化物发生原子荧光光谱法测量化妆品中Sb的价态[J]. 分析仪器, 2012(1): 85-90. doi: 10.3969/j.issn.1001-232X.2012.01.021
Xiao R, Zhang X Z, Wang C Z, et al. Valent speciation analysis of antimony in cosmetics by hydride generation atomic fluorescence spectrometry[J]. Analytical Instrument, 2012(1): 85-90. doi: 10.3969/j.issn.1001-232X.2012.01.021
[6] 刘丽瑛. 土壤中三价锑和五价锑含量的测定[J]. 广东化工, 2018, 45(12): 230-231, 229. doi: 10.3969/j.issn.1007-1865.2018.12.102
Liu L Y. Determination of trivalent antimony and pentavalent antimony in soil[J]. Guangdong Chemical Industry, 2018, 45(12): 230-231, 229. doi: 10.3969/j.issn.1007-1865.2018.12.102
[7] 王梅, 张红香, 邹志辉, 等. 原子荧光光谱法测定富硒螺旋藻片中不同形态、价态的硒[J]. 食品科学, 2011, 32(6): 179-182. https://www.cnki.com.cn/Article/CJFDTOTAL-SPKX201106042.htm
Wang M, Zhang H X, Zou Z H, et al. Determination of chemical state and valence for selenium in Se-enriched S. pirulina tablets by atomic fluorescence spectrometry[J]. Journal of Food Science, 2011, 32(6): 179-182. https://www.cnki.com.cn/Article/CJFDTOTAL-SPKX201106042.htm
[8] 薛超群, 郭敏. 氢化物发生-原子荧光光谱法测定土壤样品中不同价态的硒[J]. 岩矿测试, 2012, 31(6): 980-984. doi: 10.3969/j.issn.0254-5357.2012.06.012 http://www.ykcs.ac.cn/article/id/ykcs_20120613
Xue C Q, Guo M. Analysis of different valence states of selenium in geological samples by hydride generation-atomic fluorescence spectrometry[J]. Rock and Mineral Analysis, 2012, 31(6): 980-984. doi: 10.3969/j.issn.0254-5357.2012.06.012 http://www.ykcs.ac.cn/article/id/ykcs_20120613
[9] Issa N B, Rajakovic-Ognjanovic V N, Jovanovic B M, et al. Determination of inorganic arsenic species in natural waters-Benefits of separation and preconcentration on ion exchange and hybrid resins[J]. Analytica Chimica Acta, 2010, 673(2): 185-193. doi: 10.1016/j.aca.2010.05.027
[10] 杨总, 吴琼玉, 陈锋. 地质样品中铬的价态分析方法研究[J]. 分析试验室, 2009, 28(A1): 118-121. https://www.cnki.com.cn/Article/CJFDTOTAL-FXSY2009S1035.htm
Yan Z, Wu Q Y, Chen F. Research on geological sample analysis of valence states of chromium[J]. Chinese Journal of Analysis Laboratory, 2009, 28(A1): 118-121. https://www.cnki.com.cn/Article/CJFDTOTAL-FXSY2009S1035.htm
[11] 闫美, 谢晨星, 朱智惠, 等. 保健食品中三价铬与六价铬的分离与测定[J]. 食品研究与开发, 2016, 37(7): 171-175. doi: 10.3969/j.issn.1005-6521.2016.07.042
Yan M, Xie C X, Zhu Z H, et al. The research on the conditions of hexavalent chromium convert to trivalent chromium in healthy food[J]. Food Research and Development, 2016, 37(7): 171-175. doi: 10.3969/j.issn.1005-6521.2016.07.042
[12] Zhang N, Suleiman J S, He M, et al. Chromium(Ⅲ)-imprinted silica gel for speciation analysis of chromium in environmental water sample with ICP-MS Detection[J]. Talanta, 2008, 75(2): 536-543. doi: 10.1016/j.talanta.2007.11.059
[13] 吴少雄, 邢志, 陈红兵, 等. 磁性纳米四氧化三铁选择性富集-电感耦合等离子体原子发射光谱测定砷[J]. 分析化学, 2009, 37(5): 711-714. doi: 10.3321/j.issn:0253-3820.2009.05.017
Wu S X, Xing Z, Chen H B, et al. Nanomagnetic material ferriferrous oxide separation/enrichment and inductively coupled plasma-atomic emission spectrometry for determination of arsenic[J]. Chinese Journal of Analytical Chemistry, 2009, 37(5): 711-714. doi: 10.3321/j.issn:0253-3820.2009.05.017
[14] 黄红霞. 离子色谱-电感耦合等离子体质谱联用测定肉类食品中的无机砷[J]. 理化检验(化学分册), 2010, 46(10): 1122-1124. https://www.cnki.com.cn/Article/CJFDTOTAL-LHJH201010006.htm
Huang H X. ICP-MS determination of inorganic arsenic in meet food with IC separation[J]. Physical Testing and Chemical Analysis Part B (Chemical Analysis), 2010, 46(10): 1122-1124. https://www.cnki.com.cn/Article/CJFDTOTAL-LHJH201010006.htm
[15] Tonietto G B, Godoy J B, Oliveira A C, et al. Simultaneous speciation of arsenic (As(Ⅲ), MMA, DMA, and As(Ⅴ)) and selenium (Se(Ⅳ), Se(Ⅵ), and SeCN-) in petroleum refinery aqueous streams[J]. Analytical and Bioanalytical Chemistry, 2010, 397: 1755-1761. doi: 10.1007/s00216-010-3764-y
[16] Conklin S D, Shockey N, Kubachka K, et al. Development of an ion chromatography-inductively coupled plasma-mass spectrometry method to determine inorganic arsenic in liver from chickens treated with roxarsone[J]. Journal of Agricultural and Food Chemistry, 2012, 60(37): 9394-9404. doi: 10.1021/jf302366a
[17] 林凯, 姜杰, 黎雪慧, 等. 高效液相-原子荧光光谱法(HPLC-AFS)测定大米中不同形态砷方法的研究[J]. 实用预防医学, 2013, 20(1): 98-100. doi: 10.3969/j.issn.1006-3110.2013.01.038
Lin K, Jiang J, Li X H, et al. Speciation analysis for arsenic in rice by HPLC-AFS[J]. Practical Preventive Medicine, 2013, 20(1): 98-100. doi: 10.3969/j.issn.1006-3110.2013.01.038
[18] 张硕, 弓振斌. 高灵敏度原子荧光光谱系统应用于砷、硒形态分析的研究[J]. 分析测试学报, 2014, 33(9): 979-985. doi: 10.3969/j.issn.1004-4957.2014.09.001
Zhang S, Gong Z B. Study on arsenic/selenium speciation analysis by a modified high sensitive atomic fluorescence spectrometric system[J]. Journal of Instrumental Analysis, 2014, 33(9): 979-985. doi: 10.3969/j.issn.1004-4957.2014.09.001
[19] 刘佩佩, 梅勇, 宋冠仪, 等. 土壤中形态砷的高效液相色谱-氢化物发生-原子荧光测定方法[J]. 现代预防医学, 2016, 43(24): 4500-4506. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYF201624022.htm
Liu P P, Mei Y, Song G Y, et al. Determination of arsenic in soil by HPLC-hydride generator-AFS[J]. Modern Preventive Medicine, 2016, 43(24): 4500-4506. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYF201624022.htm
[20] 陈玉红, 米健秋, 徐陆正, 等. 毛细管电泳-电感耦合等离子体质谱法联用(CE-ICP/MS)测定八种砷的化合物[J]. 环境化学, 2011, 30(7): 1374-1377. https://www.cnki.com.cn/Article/CJFDTOTAL-HJHX201107029.htm
Chen Y H, Mi J Q, Xu L Z, et al. Determination of eight arsenic compounds by capillary electrophoresis-inductively coupled plasma mass spectrometry (CE-ICP/MS)[J]. Environmental Chemistry, 2011, 30(7): 1374-1377. https://www.cnki.com.cn/Article/CJFDTOTAL-HJHX201107029.htm
[21] 黎飞, 王扬, 张成, 等. HPLC/ICP-MS法测定水质中Cr(Ⅲ)和Cr(Ⅵ)的研究[J]. 宁波大学学报, 2012, 25(3): 13-16. doi: 10.3969/j.issn.1001-5132.2012.03.003
Li F, Wang Y, Zhang C, et al. Determination of chromium species Cr(Ⅲ) and Cr(Ⅵ) in water sample by HPLC/ICP-MS[J]. Journal of Ningbo University, 2012, 25(3): 13-16. doi: 10.3969/j.issn.1001-5132.2012.03.003
[22] 黄文耀, 张颖. 反相离子对色谱-电感耦合等离子体质谱法测定明胶空心胶囊中铬的形态[J]. 中国食品卫生杂志, 2014, 26(6): 566-569. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSPZ201406018.htm
Huang W Y, Zhang Y. Determination of chromium form Cr(Ⅲ) and Cr(Ⅵ) in the gelatin hollow capsule by RPIC/ICP-MS[J]. Chinese Journal of Food Hygiene, 2014, 26(6): 566-569. https://www.cnki.com.cn/Article/CJFDTOTAL-ZSPZ201406018.htm
[23] 田勇, 刘崇华, 方晗, 等. 共沉淀法辅助分离-离子色谱与电感耦合等离子体质谱联用测定玩具材料中三价铬及超痕量六价铬[J]. 分析测试学报, 2015, 34(6): 706-710. doi: 10.3969/j.issn.1004-4957.2015.06.014
Tian Y, Liu Z H, Fang H, et al. Determination of Cr(Ⅲ) and ultratrace Cr(Ⅵ) in toy materials by co-precipitation assisted separation-ion chromatography-inductively coupled plasma mass spectrometry[J]. Journal of Instrumental Analysis, 2015, 34(6): 706-710. doi: 10.3969/j.issn.1004-4957.2015.06.014
[24] 胡玉军, 覃毅磊, 赖毅东. HPLC-ICP-MS测定乳制品中的三价铬和六价铬[J]. 现代食品科技, 2015, 34(6): 301-305. https://www.cnki.com.cn/Article/CJFDTOTAL-GZSP201404050.htm
Hu Y J, Qin Y L, Lai Y D. Determination of chromium(Ⅲ) and chromium(Ⅵ) in dairy products by HPLC-ICP-MS[J]. Modern Food Science and Technology, 2015, 34(6): 301-305. https://www.cnki.com.cn/Article/CJFDTOTAL-GZSP201404050.htm
[25] 禄春强. 液相色谱-电感耦合等离子体质谱法测定水嘴中六价铬和三价铬析出量[J]. 分析测试学报, 2016, 35(12): 1639-1642. doi: 10.3969/j.issn.1004-4957.2016.12.022
Lu C Q. Determination of chromium(Ⅵ) and chromium(Ⅲ) stripped from stopcock by liquid chromatography-inductively coupled plasma mass spectrometry[J]. Journal of Instrumental Analysis, 2016, 35(12): 1639-1642. doi: 10.3969/j.issn.1004-4957.2016.12.022
[26] 俞凌云, 罗杨, 甘霖, 等. FI-火焰原子吸收光谱法同时测定皮革中三价铬和六价铬[J]. 中国皮革, 2014, 43(13): 34-37. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGPG201413010.htm
Yu L Y, Luo Y, Gan L, et al. Determination of Cr(Ⅲ) and Cr(Ⅵ) in leather by FI-flame atomic absorption spectrometry[J]. China Leather, 2014, 43(13): 34-37. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGPG201413010.htm
[27] Liu F, Le X C, McKnight-Whitford A, et al. Antimony speciation and contamination of waters in the Xikuangshan antimony mining and smelting area, China[J]. Environmental Geochemistry and Health, 2010, 32: 401-413. doi: 10.1007/s10653-010-9284-z
[28] Séby F, Gleyzes C, Grosso O, et al. Speciation of antimony in injectable drugs used for Leishmaniasis treatment (Glucantime)by HPLC-ICP-MS and DPP[J]. Analytical and Bioanalytical Chemistry, 2012, 404: 2939-2948. doi: 10.1007/s00216-012-6427-3
[29] 侯逸众, 范云场, 朱岩, 等. 离子色谱-双阳极电化学氢化物发生-原子荧光光谱法测定当归中Sb(Ⅲ)和Sb(Ⅴ)[J]. 分析试验室, 2009, 28(10): 38-40. doi: 10.3969/j.issn.1000-0720.2009.10.010
Hou Y Z, Fan Y C, Zhu Y, et al. Antimony speciation analysis in angelica by ion chromatography-bianode electrochemical hydride generation-atomic fluorescence spectrometric detection[J]. Chinese Journal of Analysis Laboratory, 2009, 28(10): 38-40. doi: 10.3969/j.issn.1000-0720.2009.10.010
[30] Yang H L, He M C, Wang X Q. Concentration and speciation of antimony and arsenic in soil profiles around the world's largest antimony metallurgical area in China[J]. Environmental Geochemistry and Health, 2015, 37(1): 21-33. doi: 10.1007/s10653-014-9627-2
[31] Quiroz W, Astudillo F, Bravo M, et al. Antimony speciation in soils, sediments and volcanic ashes by microwave extraction and HPLC-HG-AFS detection[J]. Microchemical Journal, 2016, 129: 111-116. doi: 10.1016/j.microc.2016.06.016
[32] Jitaru P, Goenaga-Infante H, Vaslin-Reimann S, et al. A systematic approach to the accurate quantification of selenium in serum selenoalbumin by HPLC-ICP-MS[J]. Analytica Chimica Acta, 2010, 657(2): 100-107. doi: 10.1016/j.aca.2009.10.037
[33] Hsieh Y J, Jiang S J. Determination of selenium compounds in food supplements using reversed-phase liquid chromatography-inductively coupled plasma mass spectrometry[J]. Microchemical Journal, 2013, 110(9): 1-7.
[34] 秦冲, 施畅, 万秋月, 等. 高效液相色谱-电感耦合等离子体质谱联用检测土壤中的无机硒形态[J]. 岩矿测试, 2018, 37(6): 664-670. http://www.ykcs.ac.cn/article/doi/10.15898/j.cnki.11-2131/td.201803200024
Qin C, Shi C, Wan Q Y, et al. Speciation analysis of inorganic selenium in soil by high performance liquid chromatography-inductively coupled plasma-mass spectrometry[J]. Rock and Mineral Analysis, 2018, 37(6): 664-670. http://www.ykcs.ac.cn/article/doi/10.15898/j.cnki.11-2131/td.201803200024
[35] Xie X, Feng C, Ye M, et al. Speciation determination of selenium in seafood by high-performance ion-exchange chromatography-hydride generation-atomic fluorescence spectrometry[J]. Food Analytical Methods, 2015, 8: 1739-1745. doi: 10.1007/s12161-014-0055-9
[36] 黄笑寒, 李玉锋, 林婧, 等. AE-HG-AFS测定长期汞暴露人群补硒后尿中硒的形态[J]. 分析试验室, 2012, 31(1): 11-15. doi: 10.3969/j.issn.1000-0720.2012.01.003
Huang X H, Li Y H, Lin J, et al. On-line analysis of selenium species in urine samples from mercury-exposed persons supplemented with selenium-enriched yeast by AE-HG-AFS[J]. Chinese Journal of Analysis Laboratory, 2012, 31(1): 11-15. doi: 10.3969/j.issn.1000-0720.2012.01.003
[37] Chen Y W, Belzile N. High performance liquid chromatography coupled to atomic fluorescence spectrometry for the speciation of the hydride and chemical vapour-forming elements As, Se, Sb and Hg: Acritical review[J]. Analytica Chimica Acta, 2010, 671(1-2): 9-26. doi: 10.1016/j.aca.2010.05.011
[38] 李刚, 胡斯宪, 陈琳玲. 原子荧光光谱分析技术的创新与发展[J]. 岩矿测试, 2013, 32(3): 358-376. doi: 10.3969/j.issn.0254-5357.2013.03.003 http://www.ykcs.ac.cn/article/id/0c8cca2d-b0a6-46c7-be65-25f1c32a1e6b
Li G, Hu S X, Chen L L, et al. Innovation and development for atomic fluorescence spectrometry analysis[J]. Rock and Mineral Analysis, 2013, 32(3): 358-376. doi: 10.3969/j.issn.0254-5357.2013.03.003 http://www.ykcs.ac.cn/article/id/0c8cca2d-b0a6-46c7-be65-25f1c32a1e6b
[39] 刘硕勋, 黄天舒, 颜耕, 等. 土壤和沉积物中重金属锑及其价态分析方法研究进展[J]. 环境化学, 2018, 37(2): 271-278. https://www.cnki.com.cn/Article/CJFDTOTAL-HJHX201802011.htm
Liu S X, Huang T S, Yan G, et al. Research progress on the analytical methods and speciation antimony in soils and sediments[J]. Environmental Chemistry, 2018, 37(2): 271-278. https://www.cnki.com.cn/Article/CJFDTOTAL-HJHX201802011.htm
[40] 陈凌锋. 糙米中砷形态检测方法的对比研究[J]. 食品安全质量检测学报, 2020, 11(9): 6132-6135. https://www.cnki.com.cn/Article/CJFDTOTAL-SPAJ202017056.htm
Chen L F. Comparative study on the detection methods of arsenic in rice[J]. Journal of Food Safety and Quality, 2020, 11(17): 6132-6135. https://www.cnki.com.cn/Article/CJFDTOTAL-SPAJ202017056.htm
[41] 赵谋明, 郑泽洋, 刘小玲. 食品中硒的总量及化学形态分析研究进展[J]. 南方农业学报, 2019, 50(12): 2787-2796. https://www.cnki.com.cn/Article/CJFDTOTAL-GXNY201912023.htm
Zhao M M, Zheng Z Y, Liu X L. Total content determination and chemical speciation analysis of selenium in food: A review[J]. Journal of Southern Agriculture, 2019, 50(12): 2787-2796. https://www.cnki.com.cn/Article/CJFDTOTAL-GXNY201912023.htm
[42] 吕亚宁, 宋伟, 沈贵兰, 等. 高效液相色谱-电感耦合等离子体质谱法同时测定果汁饮品中砷、硒与铬元素的无机形态[J]. 分析测试学报, 2018, 37(9): 1087-1091. doi: 10.3969/j.issn.1004-4957.2018.09.018
Lv Y N, Song W, Shen G L, et al. Simultaneous determination of inorganic speciations of As, Se and Cr in juice drinks by high performance liquid chromatography-inductively coupled plasma mass spectrometry[J]. Journal of Instrumental Analysis, 2018, 37(9): 1087-1091. doi: 10.3969/j.issn.1004-4957.2018.09.018
-


 下载:
下载: