In-situ microanalysis of elemental ratios in a single oyster shell from the South Yellow Sea, China and its environmental implications
-
摘要:
碳酸盐生物壳体的周期性生长纹层是记录气候环境变化的天然材料。随着原位微区测试技术的快速发展,高分辨率的同位素和化学元素组成的快速分析显著推动了古气候环境变化及生物地球化学研究。应用激光剥蚀等离子体质谱仪(LA-ICP-MS)对南黄海现代牡蛎Crassostrea gigas壳体韧带部的元素组成进行原位微区测试,利用内标元素43Ca进行元素比值的校正,探讨了牡蛎壳中化学元素特征及其环境意义。研究的长牡蛎壳体中Mg/Ca、Sr/Ca、Na/Ca比值具有显著的季节性周期变化。环境水体物理化学性质的变化对壳体生长速率影响较大,壳中白垩质方解石和叶片方解石生长层分别对应较高和较低的环境温度,白垩方解石层具有较高的Mg/Ca、Sr/Ca和较低的Na/Ca比值。Mg/Ca比值可指示牡蛎壳体生长环境水体温度,利用前人Mg/Ca比值公式计算可以恢复与器测资料相符的近岸海水温度结果。本研究对应用LA-ICP-MS分析技术开展高分辨率的生物壳体元素组成和环境示踪研究具有借鉴意义。
Abstract:Biogenic calcium carbonates are widely used natural archives to study environmental history and human activities as they preserve a wealth of information of climatic and environmental changes. With the NIST610 glass as the reference material and 43Ca as the internal element to calibrate, major and trace elements in a modern Pacific Oyster shell (Crassostrea gigas) taken from the offshore area of South Yellow Sea near Haimen were measured with laser ablation inductively coupled plasma-mass spectrometry (LA-ICP-MS). The primary objecitve is to reveal elemental compositions and environmental implications. Our results show very good correlations between the variations in Mg/Ca, Sr/Ca, Na/Ca ratios and the seasonal growth increments of the shell. This might suggest that variations in elemental ratios of the shell are mainly controlled by physical and chemical properties of the ambient sea water. In most cases, the chalky calcite layers in oyster shells correspond to the period of higher sea water temperature, while the foliated calcite layers are associated with the period of lower temperature. In general, the chalky calcite layers are featured by high Mg/Ca and Sr/Ca and low Na/Ca ratios. By applying Mg/Ca-temperature reconstruction equation published in literature, we obtained reliable sea surface temperature for the study area based on Mg/Ca ratios in the oyster shell, which is supported by the overall consistence between gauged water temperatures and the reconstructed.
-
Key words:
- oyster shell /
- Crassostrea gigas /
- trace element /
- LA-ICP-MS /
- Mg/Ca /
- temperature
-
近年来,随着微区分析技术的快速发展,应用激光剥蚀、离子探针等对生物壳体的原位与高分辨分析受到广泛重视。原位微区分析是利用电子束轰击或激光束剥蚀进行采样,实现原位元素—同位素组成分析。自1991年Perkins等[1]使用1 064 nm激光分析贝壳的Mg、Mn、Sr等元素以来,应用激光剥蚀等离子体质谱仪(LA-ICP-MS)分析双壳类贝壳的研究越来越多[2-6]。与传统溶液法相比,激光剥蚀的原位微区分析更高效,可以更准确、连续反映生物体不同生长时期的元素和同位素组成,对建立高分辨率的环境记录具有重要的研究价值。
牡蛎是广温、广盐性的双壳纲软体动物,其钙质外骨骼具有明显的生长纹层,记录了生物体由老到新的生长时间序列,纹层的微量元素和同位素组成与周围水体存在物理化学上的动态平衡[7-9],可以作为反映气候和环境的良好替代性指标[3],如贝壳的Mg/Ca比等常用于指示水体温度[9-15];Sr/Ca比可以指示水体光照程度[16-17]或水体盐度[18-22];Na/Ca比常指示水体盐度[21-24]。传统研究手段主要通过微钻取样、磷酸法提取CO2及分析牡蛎壳的地球化学组成[20-22, 25-28],但受取样分辨率的制约,生物壳体的环境示踪研究还有很大发展空间。
本文选取南黄海海域现代长牡蛎壳体为研究对象,尝试建立生物壳体原位微区高分辨率的化学记录。长牡蛎(Crassostrea gigas)又名太平洋牡蛎,属于珍珠贝目牡蛎科牡蛎属,生长于半咸水环境,广泛分布于中国东南沿海5~40 m水深的潮下带和浅水区[29]。个体寿命可以超过15年,最适宜的盐度范围是20‰~26‰,生长水温是15~25 ℃,高于28 ℃或低于6 ℃时生长缓慢或停止[28-31]。其壳体几乎全由低镁方解石组成[31-32],在韧带部位具有明显的周期性生长层[25],牡蛎壳的年增长层通常由夏季形成的白垩质方解石(Ch,chalky calcite)较厚亮层和冬季形成的叶片状方解石(Fo,foliated calcite)较薄暗层构成[25, 27]。其壳层发育主要受控于环境温度、水深、食物来源等外部条件,是研究中国东部沿海地区河口浅海环境特征和海陆相互作用的理想材料[28, 30-31]。白垩质方解石质地较软,呈亮白色,含有宽孔,通常与春夏季节的快速生长有关[28],易受到成岩、溶解和重结晶作用的影响,通常不适合古气候重建;叶片状方解石由密集的方解石板条组成,质地较硬,呈暗灰色,更能抵抗后期环境改造的影响,其同位素或元素组成可以反映原始的环境条件[11-12]。本文应用LA-ICP-MS分析长牡蛎左壳韧带区域不同生长层的元素组成,探讨其蕴含的环境信息。
1. 材料和方法
1.1 样品来源
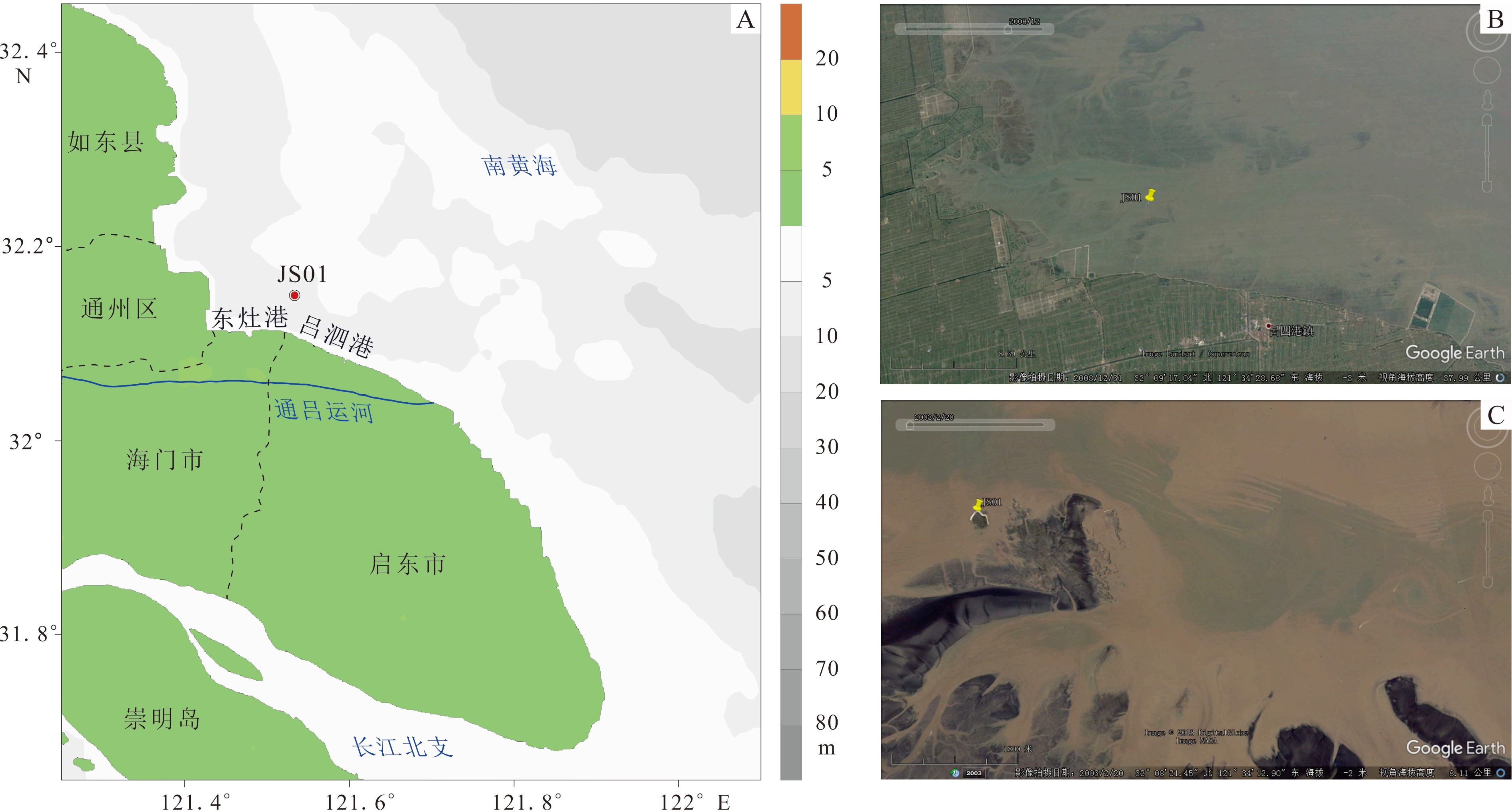
南黄海海域牡蛎滩出露于粉砂淤泥质潮滩之上,面积约3.4 km2[30, 33]。据吕四海洋站1968—2003年的实测资料,该水域冬季表层平均水温4.9 ℃,夏季表层平均水温为27.3 ℃,盐度一般为27‰~30‰,海水悬沙浓度一般为0.2~0.7 g/L[34],属中潮海岸,波浪小,年均波高低于0.3 m,大潮平均潮差大于4 m,潮流属往复流,平均流速大于1 m/s[35]。
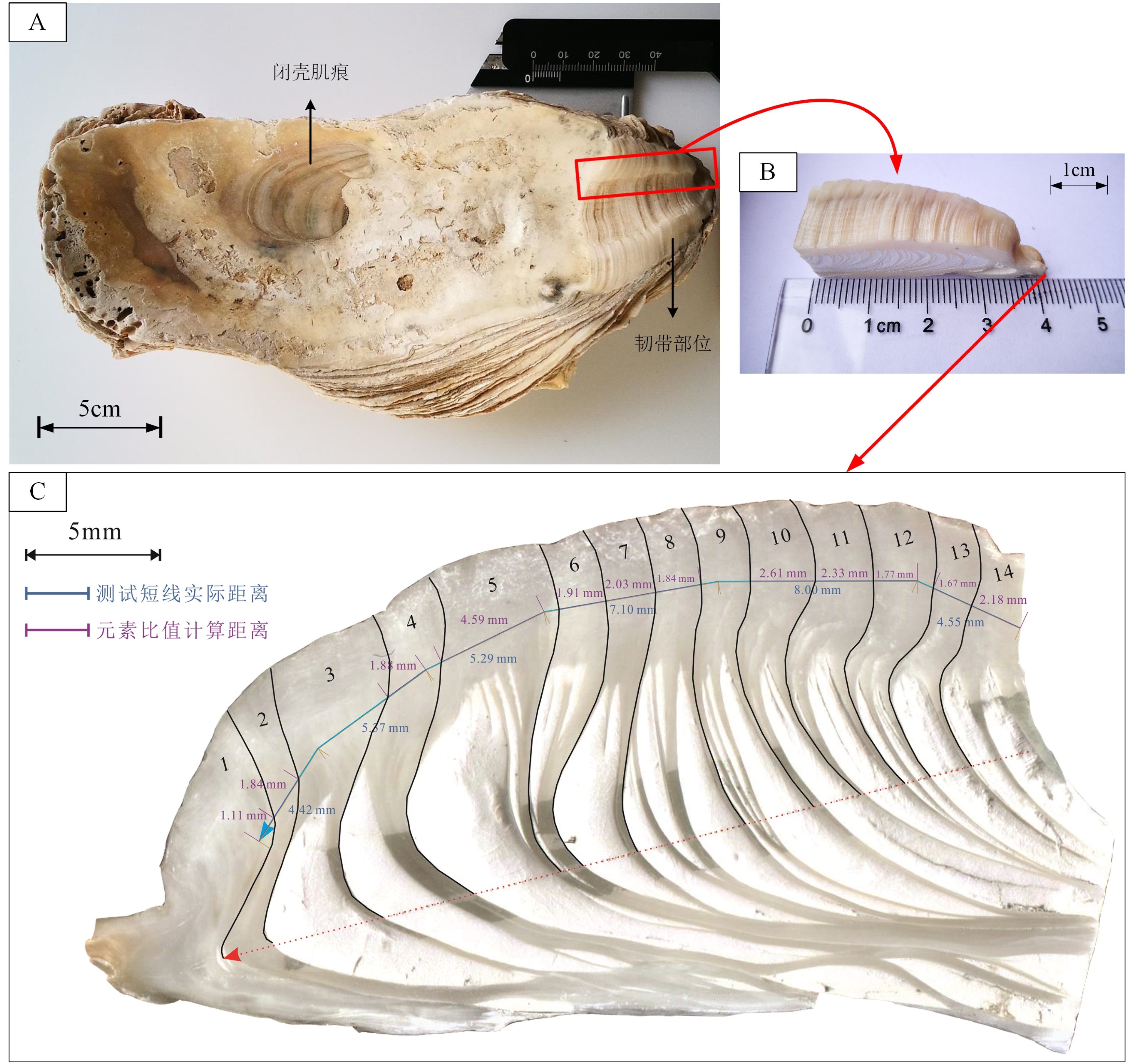
研究样品为一个已死亡长牡蛎的左壳,于2008年11月采自江苏省海门市近岸的现代南黄海海域牡蛎滩(32°09.265′N、121°32.162′E,图1)。壳体保存完好,全长约20 cm,通体黄白色,鳞片坚厚,背缘有虫蚀痕,韧带槽宽大,韧带部位、闭壳肌痕和生长缘呈同一直线,可直接通过生长层计数确定其生长年限[25, 28, 36]。
1.2 实验方法
通过将牡蛎左壳(图2A)依次以清水冲洗、干燥、沿最大生长线切割、抛光,获得长45 mm、宽10~20 mm、厚5 mm的牡蛎壳韧带部位切片(图2B)。通过肉眼和显微镜下观察,基本以一个白垩质方解石(Ch)层和一个叶片状方解石(Fo)层计作一组生长层[25, 27-28, 36],结合后续的地球化学方法进行调整,共划分14组生长层,单层宽1~4 mm,由老到新依次标记为1—14(图2C)。
原位微区测试分析应用同济大学海洋地质国家重点实验室的LA-MC-ICP-MS完成。激光剥蚀系统为Australian Scientific Instruments公司的Resolution M50L,激光光源为193 nm ArF准分子气体激光器,串接的ICP-MS为Agilent 7900型ICP-MS。外标标样为美国国家标准技术研究院NIST SRM 610人工合成玻璃,内插质控标样为NIST SRM 612玻璃,用以校正ICP-MS灵敏度漂移[37]。
在获取壳体生长年轮信息的基础上,根据壳体剖面内特征生长层的位置,选用线扫描的剥蚀方式,控制线扫描速度为15 μm/s、激光束斑为40 μm、激光能量密度为2.5 J/cm2、激光频率为6 Hz,测线沿壳体生长方向垂直于壳体剖面,自内向外、由新到老,顺叶面方解石层进行展布,进行6条连续短线剥蚀,测线总长34 725.7 μm,轨迹见图2C。线扫描方向与壳生长方向相反。总线扫时间为2 700 s,选取12~2 320 s为有效测试数据范围,并采用测试前20 s和结束后的载气平均响应值作为空白背景。
1.3 数据校正
由ICP-MS直接获取的数据为各质量数的测试响应值(单位为counts per second,即每秒的计数值,记作cps),在扣除背景空白、获取有效的计数率信号cps后,研究采用Longerich的定量方法[38]对cps进行校正,得到元素比值,具体公式如下:
Cisam/Cissam=cpsisamcpsissam/(cpsirmcpsisrm)×CirmCisrm (1) 公式(1)中,上标i表示待测元素,is代表内标元素,下标sam为待测样品,rm为标准样品,C表示元素含量。本文中测试样品sam为牡蛎壳,标准样品rm为NIST 610,内标元素is选用43Ca(牡蛎壳主要成分为CaCO3)。标样推荐值由地质环境标准物质数据库获取(GeoReM,http://georem.mpch-mainz.gwdg.de/),元素比值分析结果以摩尔比(mmol/mol, μmol/mol)形式表示。
2. 结果与讨论
2.1 壳体微量元素组成
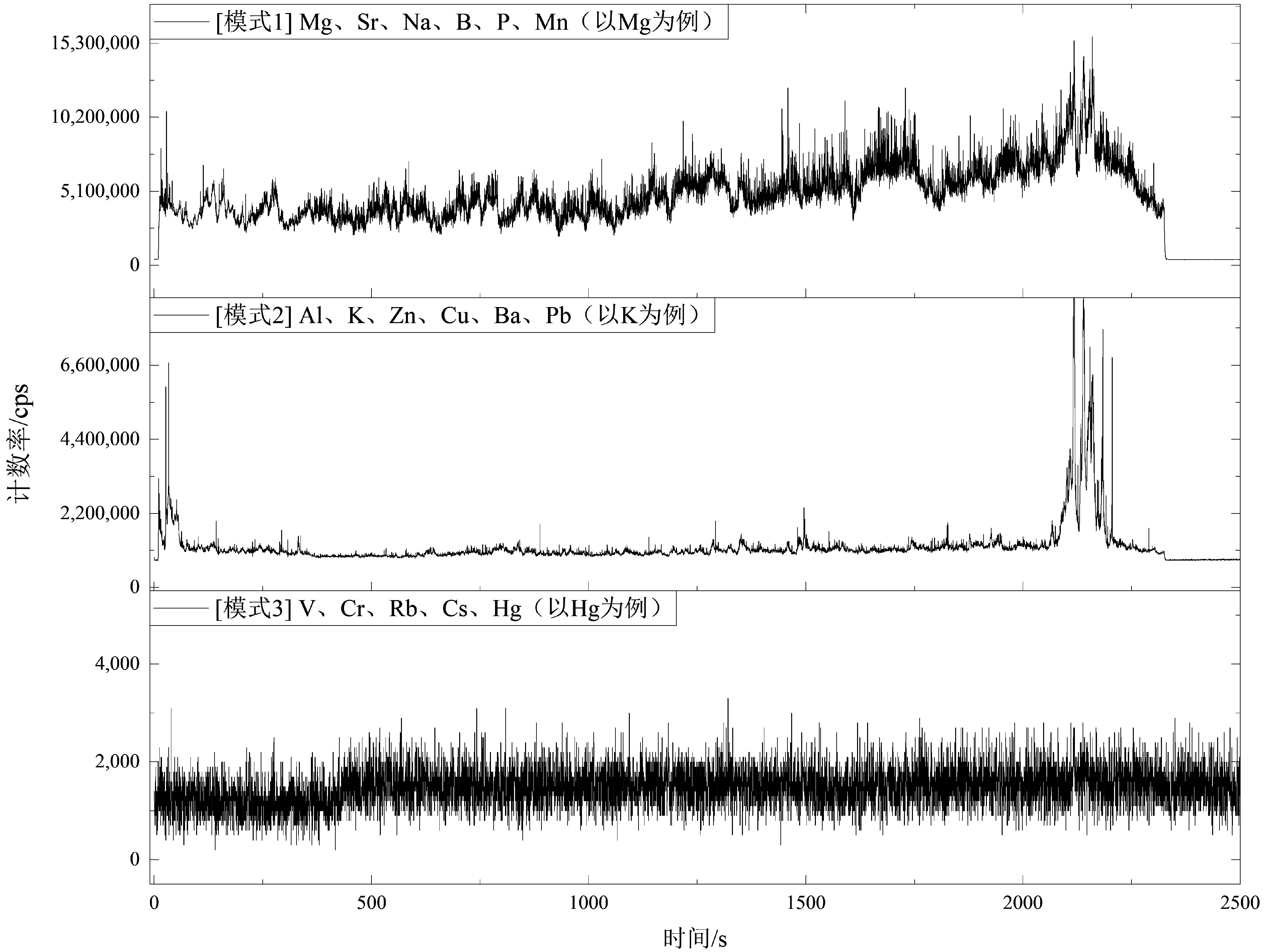
LA-ICP-MS线剥蚀模式测试长牡蛎壳体的实测元素18个,将测试元素稳定变化阶段的平均响应值记作cpssam,各元素测试时的空白背景平均信号响应值记作cpsblk,以各元素cpsblk的3σ(3倍标准差)作为样品检出限[37-38]。根据前期研究[39],当cpssam<3σ时,可以认为元素低于LA-ICP-MS检测限;3σblk≤cpssam<10σblk,元素可被检出,但仅能进行定性或半定量分析;cpssam≥10σblk,元素可进行数据定量分析。
本研究中,长牡蛎壳体的LA-ICP-MS线剥蚀信号(图3)存在3种变化模式:
(1)模式1:信号稳定且持续波动,涉及7个元素。Na、Mg、Ca、Sr的信号强度高,cpssam远超10σ,可以进行定量计算。B、P、Mn的信号同样存在持续变化,cpssam为3~10σ,可以定性分析变化趋势。
(2)模式2:剥蚀信号平均响应值cpssam相对较高,曲线上表现为个别层位出现集中单个小峰,其余90%的cpssam略高于空白,涉及6种元素:Al、K、Zn、Cu、Ba、Pb。它们的cpssam为3~10σ,仅能定性分析。
(3)模式3:V、Cr、Rb、Cs、Hg这5种元素含量较低,cpssam低于3σ,无法被LA-ICP-MS检出。
2.2 壳体微量元素与钙比值的定量分析
考虑到测试标样基体不匹配[37, 40]、碳酸盐样品的多离子团原子团干扰[4]的影响,研究中采用微量元素与Ca比值代替其绝对含量进行研究。从比值看,长牡蛎壳体中元素含量分布趋势相近。可以定性分析的元素中,K、P、Al、B、Zn、Mn 6种元素与Ca的比值为0.01~1 mmol/mol,依次为K/Ca>P/Ca>Al/Ca>B/Ca>Zn/Ca>Mn/Ca;Cu、Ba、Pb 3种元素与Ca的比值均低于10 μmol/mol,表现为Cu/Ca>Ba/Ca>Pb/Ca。
对于3种可定量的微量元素,以43Ca为内标元素,对Na/Ca、Mg/Ca、Sr/Ca通过局部加权回归散点平滑(LOESS,locally weighted scatterplot smoothing)进行信号过滤处理,提取低频率的比值信息,其中LOESS拟合比例为0.05。在整个生长周期内,Sr/Ca和Na/ Ca沿生长方向递减,而Mg/Ca反向递增;在生长后期的7~8个生长层中,Na、Mg、Sr的含量均出现了较为规律的周期性波动(图4)。
 图 4. 牡蛎样品不同生长层中Na/Ca、Mg/Ca、Sr/Ca比值变化细线表示原始元素比值,粗线表示LOESS平滑结果(黄线为Sr/Ca,蓝线为Na/Ca,红线为Mg/Ca);蓝直线表示线性拟合趋势,红色短竖线表示峰谷横坐标位置;灰色条带表示Sr/Ca与Mg/Ca低值与Na/Ca高值同期的层位,紫色条带表示Sr/Ca与Mg/Ca低值与Na/Ca低值同期的层位。Figure 4. Variations of Sr/Ca, Na/Ca and Mg/Ca ratios in the growth bands of shell carbonateThin colored lines: Original element ratio results; Thick colored lines: LOESS smoothing results(yellow: Sr/Ca, blue: Na/Ca, red: Mg/Ca); Thin blue straight lines: Linear fitting results; Red short vertical lines: the horizontal axis of the trough and peak; Grey bars shows lower values of Sr/Ca and Mg/Ca and peak values of Na/Ca, while purple bars shows the lower values of Sr/Ca, Mg/Ca and Na/Ca.
图 4. 牡蛎样品不同生长层中Na/Ca、Mg/Ca、Sr/Ca比值变化细线表示原始元素比值,粗线表示LOESS平滑结果(黄线为Sr/Ca,蓝线为Na/Ca,红线为Mg/Ca);蓝直线表示线性拟合趋势,红色短竖线表示峰谷横坐标位置;灰色条带表示Sr/Ca与Mg/Ca低值与Na/Ca高值同期的层位,紫色条带表示Sr/Ca与Mg/Ca低值与Na/Ca低值同期的层位。Figure 4. Variations of Sr/Ca, Na/Ca and Mg/Ca ratios in the growth bands of shell carbonateThin colored lines: Original element ratio results; Thick colored lines: LOESS smoothing results(yellow: Sr/Ca, blue: Na/Ca, red: Mg/Ca); Thin blue straight lines: Linear fitting results; Red short vertical lines: the horizontal axis of the trough and peak; Grey bars shows lower values of Sr/Ca and Mg/Ca and peak values of Na/Ca, while purple bars shows the lower values of Sr/Ca, Mg/Ca and Na/Ca.2.2.1 Na/Ca比值变化趋势
研究样品的Na/Ca比值为10.23~16.19 mmol/mol,中位数及均值分别为12.5和13.6 mmol/mol。在整个生长周期中,Na/Ca比值为7.1~24.4 mmol/mol,呈现明显递减趋势(yNa/Ca=0.38x+7.13, R2=0.724 0);每期生长层的叶片方解石与白垩方解石中的Na/Ca比值波动变化,高值多落在灰色致密的叶片方解石层。
已发表[8, 22-23]的文献中,牡蛎等(Crassostrea gigas, Crassostrea virginica, Aricaica islandica)壳体Na/ Ca比值为5~30 mmol/mol,且叶片方解石层具有较高的Na/ Ca比值。本研究中的C. gigas壳体Na/ Ca平均为13.6±4.7 mmol/mol(n=8 460),变化范围为7.1~24.4 mmol/mol,与文献报道基本一致。
由于碳酸盐矿物晶格中Ca2+间的空隙决定了离子替代和共沉淀的元素种类,进而决定了不同元素对方解石的亲和性差异。对于无法进行正常的结晶沉淀的Na+来说,更可能在晶体缺陷中存在[41]。Toshihiro等[42]研究发现,各种生物骨骼微观结构中的大部分Na浓度均匀,表明环境温度和生物骨骼微观结构和钙化率对生物碳酸盐骨骼中的Na浓度影响很小;但Na/Ca比值会随埋藏年龄增加而降低,这表明在埋藏成岩作用期间生物成因碳酸钙中的结构取代的Na容易被浸出,并被释放回环境水体。Rucker等[22]发现褶牡蛎C. virginica壳体中的Na、Mg、Mn、Sr与水体盐度有密切联系(相关因子为±0.3)。
因此,本研究中Na/ Ca比值的变化原因与生物本身的渗透调节机制、盐度反应[7, 21]以及长牡蛎的方解石壳的结构变化(叶片方解石和白垩方解石交替)有密切联系。生物通过调控生物碳酸盐中的Na摄入,影响了壳体中Na+的潜在储存浓度;而牡蛎壳的两种叶片方解石和白垩方解石的两种结构交替变化,影响了壳体中Na+的实际储存含量,从而造成了壳体内不同方解石生长层之间Na/ Ca比值的差异。
2.2.2 Sr/Ca与Mg/Ca比值变化特征
本研究中的C. gigas壳体Sr/Ca比为0.76±0.12 mmol/mol(n=8 460),与已发表的牡蛎C. gigas(0.83 mmol/mol,n=268[43];0.82 mmol/mol,n=271[19]),C. virginica(0.86 mmol/mol,n=10[20]),Malleus albus(0.81 mmol/mol,n=1[44])和Saxostrea gigas(1.06 mmol/mol,n=1[44])有较好的一致性。在整个生长周期中,Sr/Ca比波动递减,每期生长层中的谷值多落在灰色致密的叶片方解石层中,对应Na/ Ca的相对高值;第6~14期Sr/Ca变化相对稳定,显著低于早期生长层;第14期(末次)生长层晚期的Sr/Ca比异常升高,可能受到后期成岩作用影响。
Mg/Ca比一般为10.2~16.2 mmol/mol,中位数及均值分别为8.3和7. 9 mmol/mol。在整个生长周期中,Mg/Ca比呈上升趋势,各期叶片方解石层均具有较低的Mg/Ca比值。已发表[13-14, 19-20, 43-45]的成体和幼体牡蛎(C. gigas, C. virginica, Malleus albus, Saxostrea gigas)壳体Mg/Ca比为5.5~27 mmol/mol,同样叶片方解石层具有较低的Mg/Ca比值。
研究认为,Sr/Ca与Mg/Ca比值在壳体中差异的决定性因素为矿物晶体结构。C. gigas壳体为低镁方解石,Ca含量为37%~40%[46],低镁方解石属三方晶系结构,Ca是六次配位,六次配位的Sr2+、Ca2+和Mg2+的半径分别为1.13×10−10、1.00×10−10和0.72×10−10 m[47],因此,Sr2+和Mg2+可以类质同象的形式替换Ca2+。一般较小的阳离子有利于六次配位[47],Ca2+会优先和Mg2+替换,因此,Sr在壳体中含量显著小于Mg。
Sr/Ca与Mg/Ca比值在各生长层中差异主要反映周围水体环境特征,即牡蛎通过方解石壳的结构变化(叶片方解石和白垩方解石交替)响应环境变化,反映在壳体不同生长层的微量元素组成上。光合生物Tridacna gigas壳中,高度分辨的Sr/Ca时间序列追踪了日照周期[16-17]。C. gigas壳中的 Mg、Sr和Na浓度之间的正相关性会随着环境温度和盐度的变化而变化[19-22]。Higuera-Ruiz等[23]观察到C. gigas壳体生长层中存在每两周一次的Mg/Ca、Sr/Ca和Na/Ca周期变化,说明壳体生长受到潮汐控制,在水温较高且盐度较高的月份具有广泛的Mg/Ca、Sr/Ca高值与Na/Ca低值,并提出壳体中Mg/Ca的最小值与大潮期间冷水流入具有直接性关联。Ullmann等[19]研究表明C. gigas壳体白垩层中的Mg/Ca比值显著高于叶片层,且与氧同位素负相关,说明Mg/Ca比值与温度的高相关性;而Sr/Ca的季节变化由代谢过程控制。
本研究区水域属中潮海岸[35],波浪小,盐度为27‰~30‰,受潮汐影响显著。因此,本研究牡蛎壳体中Sr/Ca、Mg/Ca比值的变化主要受控于壳体矿物成分和潮汐控制的环境水体温盐状况。牡蛎壳的叶片方解石和白垩方解石两种结构交替变化,壳体内不同方解石生长层Sr/Ca、Mg/Ca比值差异可以指示牡蛎生长水体环境变化。
2.3 壳体Mg/Ca比值对环境海水温度的指示
方解石在固、液相中的Mg/Ca比值与温度密切相关[48]。在10‰~35‰的盐度范围内,淡水与咸水的混合对方解石Mg/Ca比值的影响微乎其微[14],因此,通常假设Mg和Ca浓度在盐度>10‰的环境中是保守的[9, 18],故双壳类钙质壳体的Mg/Ca比主要反映了环境水体温度,如贻贝[9]、扇贝[10]、牡蛎[11-14]等。Tynan等[15]总结前人研究的9种不同水体环境下双壳类壳体Mg/Ca比值与温度的关系,发现尽管不同属种对环境水体的响应方式、敏感程度不同,相同物种在不同环境下的响应敏感程度也有差异,但Mg/Ca比值与海水温度均为正相关变化,且Mg/Ca的高值对应于较温暖的时期。研究区海门近岸水文数据[33, 35]表明:研究区冬季的平均水温为4.9 ℃,夏季为27.4 ℃,季节间温差ΔT≈22.5 ℃(图5黄色阴影区所示)。归纳总结4种基于牡蛎壳体Mg/Ca比值对生长环境温度的模型并通过理论计算,探讨不同温度校准公式在本研究的适用性情况(图5)。
 图 5. 依据牡蛎Mg/Ca比值的经验校正公式获得的海水表面温度比较红线: Mouchi公式[13]计算结果,橙线: Surge公式[14],蓝线: Tynan开放海洋公式[15],绿色: Tynan河口公式[15];实线代表各校正公式建立时适用的生长层范围,虚线代表适用区外延的结果;黄色阴影区表示本研究区平均海水温度器测值的变化范围[33, 35]。Figure 5. Comparison of reconstructed sea surface temperatures based on the Mg/Ca ratios in oyster shell carbonatesMouchi Equation[13] is in red, Surge Equation[14] in orange, Tynan-ocean Equation[15] in blue, Tynan-estuary Equation[15] in green; each solid line represents the applicable zone corresponding to different growing layers, respectively, while the dash line denotes the layers lack of constraints; yellow shaded area denotes mean sea surface temperature range gauged by instruments[33, 35].
图 5. 依据牡蛎Mg/Ca比值的经验校正公式获得的海水表面温度比较红线: Mouchi公式[13]计算结果,橙线: Surge公式[14],蓝线: Tynan开放海洋公式[15],绿色: Tynan河口公式[15];实线代表各校正公式建立时适用的生长层范围,虚线代表适用区外延的结果;黄色阴影区表示本研究区平均海水温度器测值的变化范围[33, 35]。Figure 5. Comparison of reconstructed sea surface temperatures based on the Mg/Ca ratios in oyster shell carbonatesMouchi Equation[13] is in red, Surge Equation[14] in orange, Tynan-ocean Equation[15] in blue, Tynan-estuary Equation[15] in green; each solid line represents the applicable zone corresponding to different growing layers, respectively, while the dash line denotes the layers lack of constraints; yellow shaded area denotes mean sea surface temperature range gauged by instruments[33, 35].Mouchi等[13]研究了海洋环境下Crassostrea gigas长牡蛎壳体Mg/Ca比值与温度的相关性,并给出关系式:T=3.77 Mg/Ca+1.88(其中,温度单位为摄氏度℃,Mg/Ca比值单位为mmol/mol),温度校正公式适用于幼年生长层(≤2岁),温度为4.8~23.0 ℃。采用Mouchi(2013)海洋环境下的Mg/Ca-T校正公式(图5红线)时,若将所有生长层的Mg/Ca比值数据(n=8 270)代入,获得平均温度为31.6 ℃,温度变化为10.7~69.7 ℃,远超实际水温,说明该温度校正公式不适用于本研究中牡蛎壳体第1—14期所有生长层的数据(图5红虚线)。根据Mouchi所推荐的幼年(≤2岁)生长层范围,选择第1~2期生长层的Mg/Ca数据(n=717,图5红实线),获得季节性振幅之间的范围为17.6±1.7 ℃(夏季)和11.7±1.2 ℃(冬季),第1—2期生长层平均温度14.4±3.3 ℃,温度为10.7~22.7 ℃,季节间温差12.0 ℃。尽管第1—2期生长层的TMg/Ca符合Mouchi公式的温度范围,但由此获得的夏季平均温度较真实器测值(27.4 ℃)低9.8 ℃,冬季平均温度较真实器测值(4.9 ℃)高6.8 ℃,季节间温差较实际低10.5 ℃。
Surge等[14]研究了河口环境下Crassostrea virginica褶牡蛎壳体Mg/Ca比值与温度的相关性(T=1.39×Mg/Ca-0.35),该温度校正公式适用于成年生长层(中晚期),温度变化为19.1~31.4 ℃。采用Surge(2008)河口环境的Mg/Ca-T校正公式(图5橙线)时,选择第6~14期成年生长层的Mg/Ca数据(n=4 450),获得季节性温度范围为14.9±2.2 ℃(夏季)和9.6±1.6 ℃(冬季),第6—14期生长层(图5橙实线)平均温度11.9±3.2 ℃,温度变化为5.8~24.7 ℃,季节间温差18.9 ℃,公式不适用的第1—5期生长层Mg/Ca-SST在图5中用橙色虚线表示。由Surge公式获得的TMg/Ca温度变化范围及季节性温差均与真实器测值(4.9~27.4 ℃,ΔT≈ 22.5 ℃)非常接近。
Tynan等[15]提出海洋环境下Saccostrea glomerata悉尼岩牡蛎壳体Mg/Ca比值与温度的关系式为:T=1.41×Mg/Ca-3.25,温度为11~30 ℃;河口环境的T=1.23×Mg/Ca +2.90,温度为10~26 ℃,适用于幼年生长层(≤2年)。采用Tynan(2016)海洋环境的Mg/Ca-T校正公式(图5蓝线)时,所有生长层获得的季节性温度为11.1±2.5 ℃(夏季)和4.9±2.2 ℃(冬季);总平均温度7.9±3.8 ℃,温度变化范围为0.05~22.2 ℃,季节间温差ΔT≈21.1 ℃。由该公式获得的夏季平均温度较实际(27.4 ℃)低16.3 ℃,冬季平均温度与实际水温(4.9 ℃)吻合,季节间温差仅比实际温差略低1.4 ℃。采用Tynan(2016)河口环境的Mg/Ca-T校正公式(图5绿线)时,所有生长层获得的季节性温度为15.4±2.2 ℃(夏季)和10.0±1.9 ℃(冬季);总平均温度2.6±3.3 ℃,变化范围为5.8~25.1 ℃,季节间温差ΔT≈19.3 ℃。由该公式获得的夏季平均温度较器测值(27.4 ℃)低12.0 ℃,冬季平均温度较真实器测值(4.9 ℃)稍高0.9 ℃,季节间温差较实际低3.2 ℃。
综合分析以上4种模型,本文认为:
Mouchi公式中,仅第1—2期生长层的Mg/Ca-SST(指Mg/Ca比值计算获得的海水温度)处于器测温度范围内(图5红实线),但壳体早期生长层厚度变化大、Mg/Ca比值变化较为不稳定;而第3—14期生长层的Mg/Ca-SST(图5红虚线)绝大部分均超过30 ℃,显著偏高,与实际情况不符。研究区水体环境受到潮汐及近岸淡水输入影响,水体盐度(27‰~30‰)较开阔海洋环境(海水平均盐度约为34.7‰)低,故基于开阔海环境下Crassostrea gigas的Mouchi公式在此并不适用。
两种Tynan校正公式计算所得的Mg/Ca-SST大部分都落在研究区的海水温度变化范围内,但其温度校正公式仅适用于幼年生长层,实际有效部分仅存在于第1—2期生长层(图5绿实线、蓝实线),其对应的Mg/Ca-SST均低于10 ℃,显著偏低,与实际情况不符。基于海洋和河口环境下Saccostrea glomerata的两种Tynan公式均不适用本研究的原因,可归咎于Saccostrea属牡蛎与Crassostrea属牡蛎响应环境水体变化的敏感程度差异。
Surge公式能够覆盖Mg/Ca比值规律变化的第6—14期成年生长层(图5橙实线),计算得到的海水温度在冬夏季的平均温度、变化范围、季节性温差方面与研究区器测数据较为一致,符合研究区的水体温盐环境。我们推测,产生这一情况的原因在于受潮汐及河流淡水输入影响的研究区水体环境具有较高的水温和较大的季节性温盐波动[15],与Surge公式的盐度河口环境更为相似。因此,虽然Surge公式是基于与本文不同的牡蛎种(Crassostrea virginica)所获得的温度校正公式,但它却获得了与研究区近岸海水温度器测值更相符的结果。
3. 结论
(1)牡蛎是研究中国东部沿海地区河口浅海环境特征和海陆相互作用的良好载体,应用LA-ICP-MS分析技术可以揭示出长牡蛎壳体中高分辨率且连续的微量元素信息。
(2)环境水体物理化学性质的变化对壳体生长速率影响较大,牡蛎通过方解石壳的结构变化(叶片方解石和白垩方解石交替)响应环境变化,可反映在壳体不同生长层的微量元素组成上,本研究中发现对牡蛎季节性生长过程指示密切的元素有Na、Sr、Mg。
(3)牡蛎壳体中Mg/Ca可适用于该生物生活水体的温度重建。通过比较文献中现有的4种牡蛎壳体Mg/Ca比值古水温重建模型,发现由Surge等(2008)公式计算所得的近岸海水温度在冬夏季平均温度、变化范围以及季节性温差方面,更为符合研究区的海水温盐情况,而其他3种计算模型的结果与实际情况出入较大。产生上述结果的原因可能是研究区受到潮汐及近岸淡水输入影响,具有较高的水温和温盐波动。
(4)本文对于运用LA-ICP-MS分析技术开展河口海岸—边缘海地区高分辨率的壳体化石古环境重建具有借鉴意义。存在一些问题在未来的工作中值得进一步完善,包括牡蛎壳体年生长层的精细划分和对比、与现代观测数据的结合以及LA-ICP-MS分析技术基体匹配和激光线扫条件进一步优化等。
致谢:感谢博士后连尔刚、博士生杨承帆给予的指导和帮助。
-
[1] Perkins W T, Fuge R, Pearce N J G. Quantitative analysis of trace elements in carbonates using laser ablation inductively coupled plasma mass spectrometry [J]. Journal of Analytical Atomic Spectrometry, 1991, 6(6): 445-449. doi: 10.1039/ja9910600445
[2] Marali S, Schöne B R, Mertz-Kraus R, et al. Reproducibility of trace element time-series (Na/Ca, Mg/Ca, Mn/Ca, Sr/Ca, and Ba/Ca) within and between specimens of the bivalve Arctica islandica - A LA-ICP-MS line scan study [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017, 484: 109-128. doi: 10.1016/j.palaeo.2016.11.024
[3] Müller W, Fietzke J. The role of LA-ICP-MS in palaeoclimate research [J]. Elements, 2016, 12(5): 329-334. doi: 10.2113/gselements.12.5.329
[4] Jochum K P, Scholz D, Stoll B, et al. Accurate trace element analysis of speleothems and biogenic calcium carbonates by LA-ICP-MS [J]. Chemical Geology, 2012, 318-319: 31-44. doi: 10.1016/j.chemgeo.2012.05.009
[5] Schöne B R, Zhang Z J, Radermacher P, et al. Sr/Ca and Mg/Ca ratios of ontogenetically old, long-lived bivalve shells (Arctica islandica) and their function as paleotemperature proxies [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2011, 302(1-2): 52-64. doi: 10.1016/j.palaeo.2010.03.016
[6] Elliot M, Welsh K, Chilcott C, et al. Profiles of trace elements and stable isotopes derived from giant long-lived Tridacna gigas bivalves: potential applications in paleoclimate studies [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2009, 280(1-2): 132-142. doi: 10.1016/j.palaeo.2009.06.007
[7] Rosenthal Y, Katz A. The applicability of trace elements in freshwater shells for paleogeochemical studies [J]. Chemical Geology, 1989, 78(1): 65-76. doi: 10.1016/0009-2541(89)90052-1
[8] Carriker M R, Swann C P, Ewart J, et al. Ontogenetic trends of elements (Na to Sr) in prismatic shell of living Crassostrea virginica (Gmelin) grown in three ecologically dissimilar habitats for 28 weeks: a proton probe study [J]. Journal of Experimental Marine Biology and Ecology, 1996, 201(1-2): 87-135. doi: 10.1016/0022-0981(96)00013-5
[9] Putten E V, Dehairs F, Keppens E, et al. High resolution distribution of trace elements in the calcite shell layer of modern Mytilus edulis: environmental and biological controls [J]. Geochimica et Cosmochimica Acta, 2000, 64(6): 997-1011. doi: 10.1016/S0016-7037(99)00380-4
[10] Freitas P S, Clarke L J, Kennedy H, et al. Ion microprobe assessment of the heterogeneity of Mg/Ca, Sr/Ca and Mn/Ca ratios in Pecten maximus and Mytilus edulis (bivalvia) shell calcite precipitated at constant temperature [J]. Biogeosciences, 2009, 6(7): 1209-1227. doi: 10.5194/bg-6-1209-2009
[11] Bougeois L, de Rafélis M, Reichart G J, et al. A high resolution study of trace elements and stable isotopes in oyster shells to estimate Central Asian Middle Eocene seasonality [J]. Chemical Geology, 2014, 363: 200-212. doi: 10.1016/j.chemgeo.2013.10.037
[12] Bougeois L, de Rafélis M, Reichart G J, et al. Mg/Ca in fossil oyster shells as palaeotemperature proxy, an example from the Palaeogene of Central Asia [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2016, 441: 611-626. doi: 10.1016/j.palaeo.2015.09.052
[13] Mouchi V, de Rafélis M, Lartaud F, et al. Chemical labelling of oyster shells used for time-calibrated high-resolution Mg/Ca ratios: a tool for estimation of past seasonal temperature variations [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 373: 66-74. doi: 10.1016/j.palaeo.2012.05.023
[14] Surge D, Lohmann K C. Evaluating Mg/Ca ratios as a temperature proxy in the estuarine oyster, Crassostrea virginica [J]. Journal of Geophysical Research, 2008, 113(G2): G02001.
[15] Tynan S, Opdyke B N, Walczak M, et al. Assessment of Mg/Ca in Saccostrea glomerata (the Sydney rock oyster) shell as a potential temperature record [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017, 484: 79-88. doi: 10.1016/j.palaeo.2016.08.009
[16] Warter V, Müller W. Daily growth and tidal rhythms in Miocene and modern giant clams revealed via ultra-high resolution LA-ICPMS analysis - a novel methodological approach towards improved sclerochemistry [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017, 465: 362-375. doi: 10.1016/j.palaeo.2016.03.019
[17] Sano Y, Kobayashi S, Shirai K, et al. Past daily light cycle recorded in the strontium/calcium ratios of giant clam shells [J]. Nature Communications, 2012, 3(1): 761. doi: 10.1038/ncomms1763
[18] Dodd J R, Crisp E L. Non-linear variation with salinity of Sr/Ca and Mg/Ca ratios in water and aragonitic bivalve shells and implications for paleosalinity studies [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 1982, 38(1-2): 45-56. doi: 10.1016/0031-0182(82)90063-3
[19] Ullmann C V, Böhm F, Rickaby R E M, et al. The giant Pacific Oyster (Crassostrea gigas) as a modern analog for fossil ostreoids: Isotopic (Ca, O, C) and elemental (Mg/Ca, Sr/Ca, Mn/Ca) proxies [J]. Geochemistry, Geophysics, Geosystems, 2013, 14(10): 4109-4120. doi: 10.1002/ggge.20257
[20] Lerman A. Strontium and magnesium in water and in Crassostrea Calcite [J]. Science, 1965, 150(3697): 745-751. doi: 10.1126/science.150.3697.745
[21] Immega N T. Environmental influences on trace element concentrations in some modern and fossil oysters[D]. Doctor Dissertation of Indiana University, 1976.
[22] Rucker J B, Valentine J W. Salinity response of trace element concentration in Crassostrea virginica [J]. Nature, 1961, 190(4781): 1099-1100. doi: 10.1038/1901099a0
[23] Higuera-Ruiz R, Elorza J. Biometric, microstructural, and high-resolution trace element studies in Crassostrea gigas of Cantabria (Bay of Biscay, Spain): anthropogenic and seasonal influences [J]. Estuarine, Coastal and Shelf Science, 2009, 82(2): 201-213. doi: 10.1016/j.ecss.2009.01.001
[24] Zhao L Q, Schöne B R, Mertz-Kraus R. Delineating the role of calcium in shell formation and elemental composition of Corbicula fluminea (Bivalvia) [J]. Hydrobiologia, 2017, 790(1): 259-272. doi: 10.1007/s10750-016-3037-7
[25] Kent B W. Making Dead Oysters Talk: Techniques for Analyzing Oysters from Archaeological Sites[M]. Crownsville: Maryland Historical & Cultural Publications, 1992.
[26] Kirby M X, Soniat T M, Spero H J. Stable Isotope sclerochronology of Pleistocene and recent oyster shells (Crassostrea virginica) [J]. Palaios, 1998, 13(6): 560-569. doi: 10.2307/3515347
[27] Lartaud F, de Rafelis M, Ropert M, et al. Mn labelling of living oysters: artificial and natural cathodoluminescence analyses as a tool for age and growth rate determination of C. gigas (Thunberg, 1793) Shells [J]. Aquaculture, 2010, 300(1-4): 206-217. doi: 10.1016/j.aquaculture.2009.12.018
[28] 范昌福, 王宏, 裴艳东, 等. 牡蛎壳体的同位素贝壳年轮研究[J]. 地球科学进展, 2010, 25(2):163-173
FAN Changfu, WANG Hong, PEI Yandong, et al. Stable isotope sclerochronology study of oyster shells [J]. Advances in Earth Science, 2010, 25(2): 163-173.
[29] 徐凤山, 张素萍, 王少青. 中国海产双壳类图志[M]. 北京: 科学出版社, 2008.
XU Fengshan, ZHANG Suping, WANG Shaoqing. An Illustrated Bivalvia Mollusca Fauna of China Seas[M]. Beijing: China Ocean Press, 2008.
[30] 王建, 赵梅, 白世彪, 等. 黄海南部海门近岸牡蛎礁发育的物质基础与环境背景[J]. 地理研究, 2009, 28(5):1170-1178 doi: 10.3321/j.issn:1000-0585.2009.05.003
WANG Jian, ZHAO Mei, BAI Shibiao, et al. Environmental background of oyster reef development in near-shore Haimen of southern Yellow Sea [J]. Geographical Research, 2009, 28(5): 1170-1178. doi: 10.3321/j.issn:1000-0585.2009.05.003
[31] Wang H, Van Strydonck M. Chronology of Holocene cheniers and oyster reefs on the coast of Bohai Bay, China [J]. Quaternary Research, 1997, 47(2): 192-205. doi: 10.1006/qres.1996.1865
[32] Kirby M X. Paleoecological differences between Tertiary and Quaternary Crassostrea Oysters, as revealed by stable isotope sclerochronology [J]. Palaios, 2000, 15(2): 132-141. doi: 10.1669/0883-1351(2000)015<0132:PDBTAQ>2.0.CO;2
[33] 张忍顺, 王艳红, 张正龙, 等. 江苏小庙洪牡蛎礁的地貌特征及演化[J]. 海洋与湖沼, 2007, 38(3):259-265 doi: 10.3321/j.issn:0029-814X.2007.03.012
ZHANG Renshun, WANG Yanhong, ZHANG Zhenglong, et al. Geomorphology and evolution of the Xiaomiaohong oyster reef off Jiangsu Coast, China [J]. Oceanologia et Limnologia Sinica, 2007, 38(3): 259-265. doi: 10.3321/j.issn:0029-814X.2007.03.012
[34] 宋召军, 黄海军, 杜廷芹, 等. 南黄海辐射沙洲附近海域悬浮体的研究[J]. 海洋地质与第四纪地质, 2006, 26(6):19-25
SONG Zhaojun, HUANG Haijun, DU Tingqin, et al. Suspended sediment near radial sand ridge area in the South Yellow Sea [J]. Marine Geology & Quaternary Geology, 2006, 26(6): 19-25.
[35] 任美锷. 江苏省海岸带和海涂资源综合调查[M]. 北京: 科学出版社, 1986: 19-44.
REN Mei'e. Comprehensive Investigation of Coastal Zone and Tidal Flat Resources, Jiangsu Province[M]. Beijing: China Ocean Press, 1986: 19-44.
[36] Harding J M, Mann R. Age and growth of wild Suminoe (Crassostrea ariakensis, fugita 1913) and Pacific (C. gigas, Thunberg 1793) oysters from Laizhou bay, China [J]. Journal of Shellfish Research, 2015, 25(1): 73-82.
[37] 刘勇胜, 胡兆初, 李明, 等. LA-ICP-MS在地质样品元素分析中的应用[J]. 科学通报, 2013, 58(32):3863-3878 doi: 10.1007/s11434-013-5901-4
LIU Yongsheng, HU Zhaochu, LI Ming, et al. Applications of LA-ICP-MS in the elemental analyses of geological samples [J]. Chinese Science Bulletin, 2013, 58(32): 3863-3878. doi: 10.1007/s11434-013-5901-4
[38] Longerich H P, Jackson S E, Günther D. Inter-laboratory note. Laser ablation inductively coupled plasma mass spectrometric transient signal data acquisition and analyte concentration calculation [J]. Journal of Analytical Atomic Spectrometry, 1996, 11(9): 899-904. doi: 10.1039/JA9961100899
[39] 徐金龙, 刘中勇, 华斌, 等. 分析化学中检出限问题探讨[J]. 检验检疫学刊, 2012, 22(6):74-76
XU Jinlong, LIU Zhongyong, HUA Bin, et al. Discussion of detection limit concept question in analytical chemistry [J]. Journal of Inspection and Quarantine, 2012, 22(6): 74-76.
[40] 陈璐. 碳酸岩样品微量元素LA-ICP-MS微区原位准确分析方法研究[D]. 中国地质大学硕士学位论文, 2011.
CHEN Lu. In situ accurate analysis of trace elements of carbonate by LA-ICP-MS[D]. Master Dissertation of China University of Geosciences, 2011.
[41] Morse J W, Mackenzie F T. Geochemistry of Sedimentary Carbonates[M]. New York: Elsevier Science Publishers Company, 1990.
[42] Yoshimura T, Tamenori Y, Suzuki A, et al. Altervalent substitution of sodium for calcium in biogenic calcite and aragonite [J]. Geochimica et Cosmochimica Acta, 2017, 202: 21-38. doi: 10.1016/j.gca.2016.12.003
[43] Almeida M J, Machado J, Moura G, et al. Temporal and local variations in biochemical composition of Crassostrea gigas shells [J]. Journal of Sea Research, 1998, 40(3-4): 233-249. doi: 10.1016/S1385-1101(98)00033-1
[44] Ohde S, Kitano Y. Coprecipitation of strontium with marine Ca-Mg carbonates [J]. Geochemical journal, 1984, 18(3): 143-146. doi: 10.2343/geochemj.18.143
[45] Durham S R, Gillikin D P, Goodwin D H, et al. Rapid determination of oyster lifespans and growth rates using LA-ICP-MS line scans of shell Mg/Ca ratios [J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017, 485: 201-209. doi: 10.1016/j.palaeo.2017.06.013
[46] 刘文, 李天华, 张滕军, 等. 牡蛎壳中钙的改性及吸附特性的研究[J]. 材料导报, 2012, 26(18):88-92 doi: 10.3969/j.issn.1005-023X.2012.18.024
LIU Wen, LI Tianhua, ZHANG Tengjun, et al. Study on modification of calcium and adsorbability of oyster shells [J]. Materials Review, 2012, 26(18): 88-92. doi: 10.3969/j.issn.1005-023X.2012.18.024
[47] 余克服, 赵焕庭, 朱袁智. 南沙群岛永暑礁等8座环礁现代沉积物中Ca、Sr、Mg的特征[J]. 海洋通报, 1996, 15(3):54-63
YU Kefu, ZHAO Huanting, ZHU Yuanzhi. Content characters about Ca, Sr and Mg in modern sediments from eight atolls of Nansha Islands [J]. Marine Science Bulletin, 1996, 15(3): 54-63.
[48] Mucci A. Influence of temperature on the composition of magnesian calcite overgrowths precipitated from seawater [J]. Geochimica et Cosmochimica Acta, 1987, 51(7): 1977-1984. doi: 10.1016/0016-7037(87)90186-4
期刊类型引用(2)
1. 常健玮,刘国群,颜雯婷,刘洋,徐铖,陈敏,秦华. 牡蛎壳粉替代石灰对橘园土壤酸化改良及果实品质的影响. 中国土壤与肥料. 2024(10): 136-141 .  百度学术
百度学术
2. 林梵宇,尹希杰,黄威,黄杰超,梁毓娜. 利用微区XRF技术的大洋固体矿产成分快速无损检测. 海洋地质与第四纪地质. 2021(01): 223-232 .  本站查看
本站查看
其他类型引用(1)
-




 下载:
下载: